การรีดักชั่น (Reduction) เป็นแนวคิดที่สำคัญในวิชาเคมี ซึ่งเชื่อมโยงอย่างใกล้ชิดกับออกซิเดชัน (Oxidation) ที่เหมือนกัน เมื่อรวมกันแล้วจะก่อให้เกิดพื้นฐานของปฏิกิริยารีดอกซ์ (Redox-Oxidation) ซึ่งเป็นพื้นฐานของกระบวนการทางเคมีหลายอย่าง
การทำความเข้าใจการรีดักชั่น (Reduction) และกลไกนี้เป็นสิ่งสำคัญในการทำความเข้าใจว่าสารมีปฏิสัมพันธ์ เปลี่ยนรูปและส่งผลกระทบต่อระบบต่างๆ อย่างไร ตั้งแต่สิ่งมีชีวิตทางชีวภาพไปจนถึงการใช้งานทางอุตสาหกรรม
นิยามของการรีดักชั่น (Reduction)
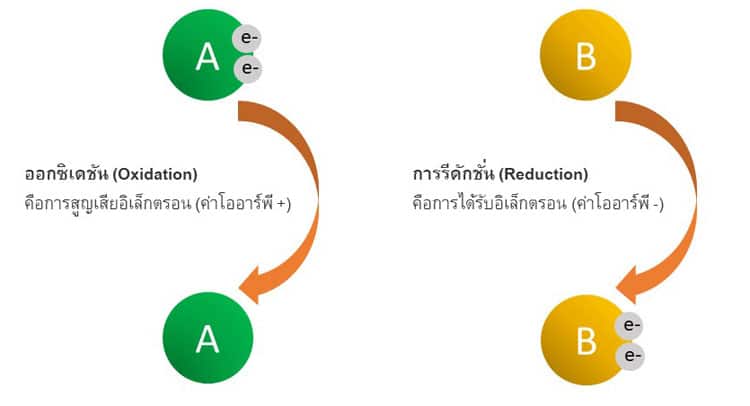
ในทางเคมีการรีดักชัน (Reduction) คือการได้รับอิเล็กตรอนจากอะตอม ไอออน หรือโมเลกุล การได้รับอิเล็กตรอนนี้ส่งผลให้สถานะออกซิเดชันของสารลดลง
การรีดักชั่นจะจับคู่กับออกซิเดชันเสมอ โดยที่สารอื่นสูญเสียอิเล็กตรอน ส่งผลให้สถานะออกซิเดชันเพิ่มขึ้น สารที่ผ่านการรีดักชันเรียกว่าสารออกซิไดซ์เนื่องจากรับอิเล็กตรอนซึ่งเอื้อต่อการเกิดออกซิเดชันของสารอื่น
ประวัติศาสตร์
แนวคิดเรื่องการรีดักชั่นได้พัฒนาไปตามกาลเวลา ในอดีตมีคำนิยามในแง่ของการกำจัดออกซิเจนออกจากสารประกอบ ตัวอย่างเช่นการลดออกไซด์ของโลหะให้เป็นโลหะโดยใช้คาร์บอน (ในรูปของถ่าน) เป็นตัวอย่างคลาสสิก:
Fe2O3+3C → 2Fe+3CO
อย่างไรก็ตาม คำจำกัดความสมัยใหม่มุ่งเน้นไปที่การถ่ายโอนอิเล็กตรอน ซึ่งให้ความเข้าใจที่ครอบคลุมมากขึ้นเกี่ยวกับปฏิกิริยามากมายที่การลดลงมีบทบาท
ตัวอย่างสำคัญของการรีดักชั่น
1. ในทางโลหะวิทยา (Metallurgy): การสกัดโลหะออกจากแร่ การรีดักชั่นถือเป็นขั้นตอนสำคัญ ตัวอย่างเช่นเหล็กถูกสกัดจากแร่เหล็ก (เฮมาไทต์) โดยการใช้คาร์บอนมอนอกไซด์ในเตาถลุงเหล็ก:
Fe2O3+3CO → 2Fe+3CO2
2. ในทางไฟฟ้าเคมี (Electrochemistry): ในเซลล์ไฟฟ้าเคมี การรีดักชันเกิดขึ้นที่แคโทด ตัวอย่างเช่นในเซลล์กัลวานิกสังกะสี-ทองแดง ไอออนของทองแดงจะได้รับอิเล็กตรอนและลดลงเป็นโลหะทองแดงที่แคโทด:
Cu2+ + 2e− → Cu
3. ในทางดานเคมีอินทรีย์ (Organic Chemistry): ปฏิกิริยารีดักชันมีความสำคัญในเคมีอินทรีย์สำหรับการแปลงหมู่ฟังก์ชัน การเติมไฮโดรเจนหรือการเติมไฮโดรเจนลงในพันธะคู่หรือสามเป็นกระบวนการรีดักชันทั่วไป:
C2H4 + H2 → C2H6
กลไกการการรีดักชั่นอาจเกิดขึ้นได้จากกลไกต่างๆ ได้แก่:
- การถ่ายโอนอิเล็กตรอนโดยตรง: เมื่ออิเล็กตรอนถูกถ่ายโอนโดยตรงจากอะตอมหนึ่งไปยังอีกอะตอม
- การถ่ายโอนไฮไดรด์: พบได้ทั่วไปในรีดักชันอินทรีย์ โดยที่ไฮไดรด์ไอออน (H-) ถูกถ่ายโอนไปยังซับสเตรต
- การเติมไฮโดรเจน: เช่น ในการเร่งปฏิกิริยาไฮโดรจิเนชัน โดยที่ก๊าซไฮโดรเจนถูกเติมเข้าไปในพันธะคู่หรือสาม

การวัดปฎิกิริยารีดักชั่น (Reduction)
การวัดค่า Oxidation Reduction Potential ทำได้โดยใช้ ORP Meter ซึ่งจะให้ค่าได้ทั้ง (+) และ (-) ในหน่วยมิลลิโวลท์ (mV) ดูรายละเอียดเพิ่มเติมได้ที่เข้าใจเครื่องวัด ORP Meter: วิธีการทำงานและการใช้งาน
การประยุกต์ใช้การรีดักชั่น
- กระบวนการทางอุตสาหกรรมอาศัยปฏิกิริยารีดักชันได้แก่การผลิตโลหะ ปุ๋ย และปิโตรเคมี
- ระบบชีวภาพ: การหายใจระดับเซลล์เกี่ยวข้องกับปฏิกิริยารีดอกซ์โดยที่กลูโคสจะถูกออกซิไดซ์ และออกซิเจนถูกรีดิวซ์เป็นน้ำ
- เคมีสิ่งแวดล้อม: จะใช้ในการบำบัดมลพิษเช่นการลดไนเตรตไอออนให้เป็นก๊าซไนโตรเจนในการบำบัดน้ำเสีย

บทสรุป
การรีดิวซ์เป็นแนวคิดพื้นฐานในวิชาเคมีที่เกี่ยวข้องกับการได้รับอิเล็กตรอนและสถานะออกซิเดชันที่ลดลง การใช้งานมีมากมายและจำเป็น โดยส่งผลกระทบต่อทุกอย่างตั้งแต่กระบวนการทางอุตสาหกรรมไปจนถึงระบบชีวภาพ การทำความเข้าใจการลดลงไม่เพียงแต่ให้ความกระจ่างถึงธรรมชาติของปฏิกิริยาเคมีเท่านั้น
แต่ยังให้เครื่องมือในการจัดการและควบคุมปฏิกิริยาเหล่านี้เพื่อวัตถุประสงค์ต่างๆ ไม่ว่าจะในห้องปฏิบัติการ โรงงานอุตสาหกรรม หรือระบบชีวภาพ หลักการของการลดยังคงขับเคลื่อนนวัตกรรมและการค้นพบทางวิทยาศาสตร์เคมีต่อไป
บทความที่เกี่ยวข้อง









